
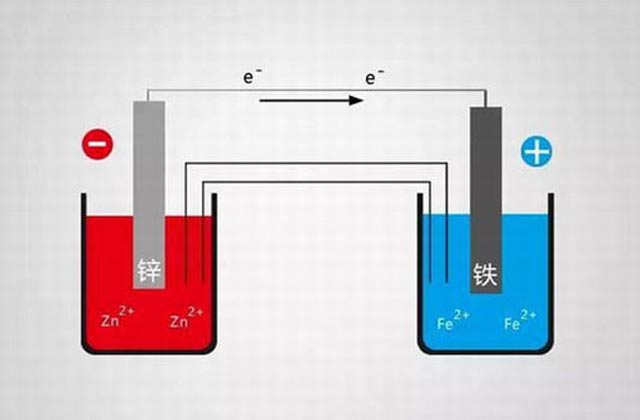
其一,电化学保护作用。由于锌比铁活泼,容易失去电子,在腐蚀前期过程中,锌粉和钢铁基材组成原电池,锌的电极电位比铁的电极电位负,锌为阳极(通常称牺牲阳极),铁为阴极,电流由锌流向铁,钢铁基材便得到了阴极保护。电化学反应 Fe→Fe2++2e-;Zn→Zn2++2e-。
其二,锌腐蚀沉积物屏蔽保护。在腐蚀后期过程中,锌粉漆在应用过程中不断被腐蚀,锌粉间隙和钢铁表面沉积了腐蚀产物,即碱式碳酸锌,俗称“白锈”,其结构致密,且不导电,是难溶的稳定化合物,能够阻挡和屏蔽腐蚀介质的侵蚀,起到防蚀效果,因此也被誉为锌粉漆的“自修复”性。

Zn+2H2O=Zn(OH)2+H2Zn(OH)2=ZnO+H2O5ZnO+2CO2=2ZnCO3・
3Zn(OH)2+H2O5ZnO+2CO2+3H2O=2ZnCO3・3Zn(OH)2
含有大量锌粉的底漆通过上述两种机理最终使钢铁基材得到保护。
